Появляется ли новый водород во Вселенной?
В космосе водород выступает в трех ипостасях — ядро водорода (протон), атомарный и молекулярный водород. Максимальное число протонов по-видимому было в Адронную эпоху при температурах 10¹⁰ ÷ 10¹² К, когда возраст Вселенной был 10⁻⁶ ÷ 1 сек и кварк-глюонная плазма охлаждалась, образованием протонов и других адронов.
Число протонов начало неуклонно уменьшаться в эпоху ядерного синтеза при температурах Вселенной 10⁷ ÷ 10⁹ К и возрасте 10 ÷ 1000 сек, когда начали синтезироваться первые легчайшие ядра — Дейтерий и Гелий.
В эпоху рекомбинации во Вселенной (возраст 380000 лет) уже стало относительно прохладнее (температура
4000 К) и электроны и протоны стали формировать первые нейтральные атомы (водород, гелий, литий).
С момента формирования первых звёзд (Вселенной 0,15 ÷ 1 млрд лет) водород стал тратиться в процессах синтеза и создания ядер в звёздах. Часть водорода при этом «навечно» запечатывается в атомных ядрах мёртвых (остывших) звёзд и чёрных дыр, а часть возвращается в круговорот при взрывах сверхновых и столкновениях звёзд.
Таким образом, «новые» протоны рождаются при температурах более 100 млрд К, что могло быть только на стадии эмбриональной Вселенной или при взаимодействиях высокоэнергичных космических лучей с ядрами межзвездного газа. Однако вклад последних, в уменьшающееся количество водорода во Вселенной, пренебрежимо мал.
Источник
Откуда взялись все химические элементы, если изначально во Вселенной были только гелий, водород и немного лития?
Всё, что нас окружает — предметы обихода, живая и неживая природа, состоит из атомов. Образуя химические связи, атомы простых веществ могут создавать более сложные вещества, например, два атома водорода и один атом кислорода образуют воду, без которой была бы невозможна жизнь на Земле. На сегодняшний день известно 118 химических элементов, но так было не всегда.
Изначально в природе не было никаких химических элементов. Новорожденная Вселенная представляла собой нечто вроде бульона из глюонов и кварков, которые постепенно объединялись в протоны и нейтроны — будущие атомные ядра всех известных нам веществ.
Затем последовало их слияние, в результате чего в космосе появились первые химические элементы — гелий, водород и ничтожно малое количество лития. К этому времени Вселенная уже остыла настолько, что новые элементы более не могли образовываться.
Но откуда тогда взялось всё остальное?
Чтобы привнести разнообразие в таблицу Менделеева, Вселенной потребовались космические реакторы — звезды. Начиная от звездных карликов в десять раз меньше Солнца и заканчивая сверхгигантами вроде Ригеля, все звезды начинают свой путь одинаково.
Сжигая в своих недрах самый распространенный элемент водород, они превращают его в гелий, выделяя при этом лучистую энергию. Старея, растратившие водородное топливо небольшие звезды становятся красными гигантами, в которых возникают благоприятные условия для горения уже гелия. Из него в процессе синтеза образуется углерод и в относительно малых объемах кислород. На этом роль небольших звезд в образовании химических элементов заканчивается, им просто не хватает массы, чтобы зажечь углерод.
Но что не под силу малым звездам, оказывается по плечу светилам в пять и более раз массивнее Солнца. Они синтезируют из углерода кислород, кальций, кремний и другие элементы вплоть до железа и никеля. Однако на этом этапе у большинства массивных звезд начинаются проблемы. Дело в том, что вовлечение в термоядерный синтез железа происходит не с выделением, а с поглощением энергии. Производимая ядром звезды энергия — это единственное, что удерживает звезду от коллапса. Образование же в ядре железа приводит к потере энергии, в результате чего массивная звезда теряет равновесие и в считанные доли секунды сжимается, а затем взрывается сверхновой, выбрасывая в пространство внешние слои с созданными химическими элементами. Но ведь железо в таблице Менделеева идет только под номером 26.
Откуда тогда взялись медь, серебро, золото, платина и другие элементы, если ничего тяжелее железа при термоядерной реакции образовываться не может?
На этот счет существуют разные мнения. Согласно одному такому мнению, в ходе взрыва сверхновой разлетающиеся с огромной скоростью атомные ядра сталкиваются с нейтронами и как-бы «обрастают» ими. Часть нейтронов превращаются в протоны, атомный номер ядра увеличивается, в результате чего получается новый более тяжелый элемент. Это так называемый R-процесс или быстрый захват нейтронов. Считается, что таким образом могут образовываться элементы вплоть до плутония.
Согласно другой точке зрения, R-процесс запускается при слиянии нейтронных звезд с последующим выбросом в космос энергии и вещества. Чего-чего, а нейтронов в этих звездах хоть отбавляй, вот они и вступают в взаимодействие с атомными ядрами, обогащая их и синтезируя тем самым новые элементы. Но вероятнее всего, что образование тяжелых элементов имеет место в обоих случаях.
Итак, всё что вас окружает — это продукты жизнедеятельности звезд. Воздух, которым вы дышите, вода, которую пьете, золотое кольцо на пальце вашей руки и углерод в составе клеток вашего тела — всё это создано миллиарды лет назад в недрах светил. Согласитесь, как тут не почувствовать причастность к вечности?
Источник
Получение и нахождение в космосе водорода. Ученые нашли способ добычи кислорода в космосе. Десять самых распространенных элементов в Галактике Млечный Путь
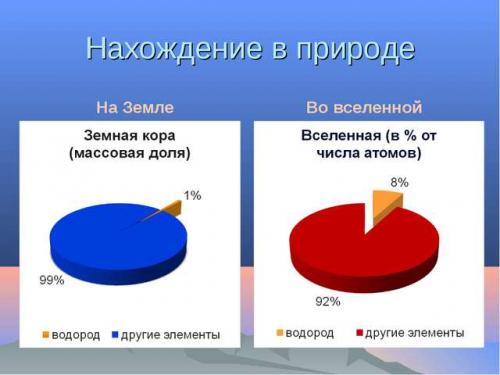
Водород (Н) очень легкий химический элемент, с содержанием в Земной коре 0,9% по массе, а в воде 11,19%.
Характеристика водорода
По легкости он первый среди газов. При нормальных условиях безвкусен, бесцветен, и абсолютно без запаха. При попадании в термосферу улетает в космос из-за малого веса.
Во всей вселенной это самый многочисленный химический элемент (75% от всей массы веществ). Настолько, что многие звезды в космическом пространстве состоят полностью из него. Например, Солнце. Его основной компонент — водород. А тепло и свет это итог выделения энергии при слиянии ядер материала. Так же в космосе есть целые облака из его молекул различной величины, плотности и температуры.
Физические свойства
Высокая температура и давление значительно меняют его качества, но при обычных условиях он:
Обладает высокой теплопроводностью, если сравнивать с другими газами,
Нетоксичен и плохо растворим в воде,
С плотностью 0,0899 г/л при 0°С и 1 атм.,
Превращается в жидкость при температуре -252,8°С
Становится твердым при -259,1°С.,
Удельная теплота сгорания 120,9.106 Дж/кг.
Для превращения в жидкость или твердое состояние требуются высокое давление и очень низкие температуры. В сжиженном состоянии он текуч и легок.
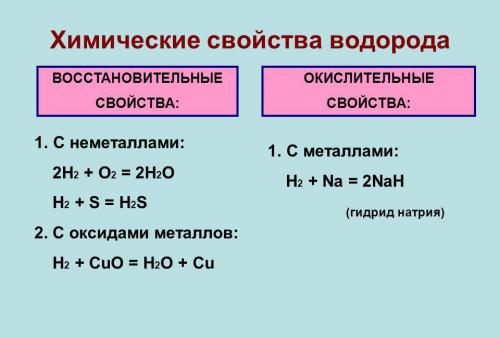
Химические свойства
Под давлением и при охлаждении (-252,87 гр. С) водород обретает жидкое состояние, которое по весу легче любого аналога. В нем он занимает меньше места, чем в газообразном виде.
Он типичный неметалл. В лабораториях его получают путем взаимодействия металлов (например, цинка или железа) с разбавленными кислотами. При обычных условиях малоактивен и вступает в реакцию только с активными неметаллами. Водород может отделять кислород из оксидов, и восстанавливать металлы из соединений. Он и его смеси образуют водородную связь с некоторыми элементами.
Газ хорошо растворяется в этаноле и во многих металлах, особенно в палладии. Серебро его не растворяет. Водород может окисляться во время сжигания в кислороде или на воздухе, и при взаимодействии с галогенами.
Во время соединения с кислородом, образуется вода. Если температура при этом обычная, то реакция идет медленно, если выше 550°С — со взрывом (превращается в гремучий газ).
Нахождение водорода в природе
Хотя водорода очень много на нашей планете, но в чистом виде его найти нелегко. Немного можно обнаружить при извержении вулканов, во время добычи нефти и в месте разложения органических веществ.
Больше половины всего количества находится в составе с водой. Так же он входит в структуру нефти, различной глины, горючих газов, животных и растений (присутствие в каждой живой клетке 50% по числу атомов).
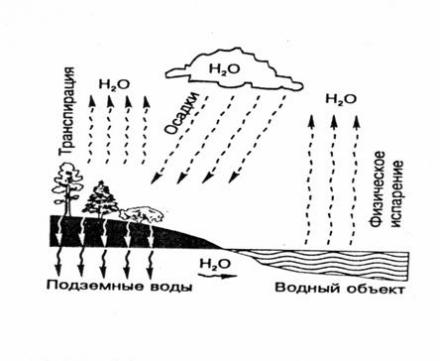
Круговорот водорода в природе
Каждый год в водоемах и почве разлагается колоссальное количество (миллиарды тонн) остатков растений и это разложение выплескивает в атмосферу огромную массу водорода. Так же он выделяется при любом брожении, вызываемом бактериями, сжигании и наравне с кислородом участвует в круговороте воды.
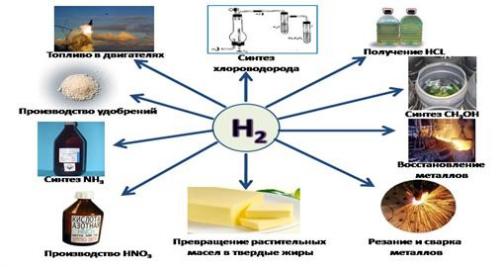
Области применения водорода
Элемент активно используется человечеством в своей деятельности, поэтому мы научились получать его в промышленных масштабах для:
Как горючее для ракет (жидкий водород)-
Электроэнергетики для охлаждения электрических генераторов-
Сварки и резки металлов.
Масса водорода используется при производстве синтетического бензина (для улучшения качества топлива низкого качества), аммиака, хлороводорода, спиртов, и других материалов. Атомная энергетика активно использует его изотопы.
Препарат «перекись водорода» широко применяют в металлургии, электронной промышленности, целлюлозно-бумажном производстве, при отбеливании льняных и хлопковых тканей, для изготовления красок для волос и косметики, полимеров и в медицине для обработки ран.
«Взрывной» характер этого газа может стать гибельным оружием — водородной бомбой. Ее взрыв сопровождается выбросом огромного количества радиоактивных веществ и губительно для всего живого.
Соприкосновение жидкого водорода и кожных покровов грозит сильным и болезненным обморожением.
Космические агентства и частные компании уже разрабатывают планы по отправке людей на Марс в ближайшие несколько лет, что в конечном итоге приведет к его колонизации. И с увеличением числа открытых землеподобных планет вокруг близлежащих звезд дальние космические путешествия становятся все более актуальными.
Однако людям нелегко выжить в космосе в течение длительного периода времени. Одной из основных проблем космического полета на большие расстояния является транспортировка достаточного количества кислорода для дыхания космонавтов и достаточного количества топлива для работы сложной электроники. К сожалению, в космосе практически нет кислорода, поэтому запасать его нужно на Земле.
Но новое исследование, опубликованное в Nature Communications , показывает, что можно производить водород (для топлива) и кислород (для дыхания) из воды, используя только полупроводниковый материал, солнечный (или звездный) свет и невесомость, что делает далекие путешествия более реальными.
Использование неограниченного ресурса Солнца для питания нашей повседневной жизни — одна из самых глобальных задач на Земле. Поскольку мы медленно отходим от нефти к возобновляемым источникам энергии, исследователи заинтересованы в возможности использования водорода в качестве топлива. Лучшим способом сделать это было бы разделение воды (H2O) на ее составляющие: водород и кислород. Это возможно с использованием процесса, известного как электролиз, который состоит в пропускании тока через воду, содержащую некоторое количество растворимого электролита (например, соли — прим. перев.). В результате вода распадается на атомы кислорода и водорода, которые выделяются каждый на своем электроде.
Электролиз воды.
Хотя этот метод технически возможен и известен уже не одно столетие, он все еще не стал легкодоступным на Земле, поскольку нам нужно больше инфраструктуры, связанной с водородом — например, заправочных станций водорода.
Водород и кислород, полученные таким образом из воды, могут также использоваться в качестве топлива на космическом корабле. Запуск ракеты с водой на самом деле был бы намного безопаснее, чем с дополнительным ракетным топливом и кислородом на борту, так как при аварии их смесь может быть взрывоопасной. Теперь же в космосе специальная технология сможет разделить воду на водород и кислород, которые, в свою очередь, могут быть использованы для поддержания дыхания и работоспособности электроники (например, с помощью топливных элементов).
Для этого есть два варианта. Один из них — это электролиз, как и на Земле, с использованием электролитов и солнечных батарей для получения тока. Но, увы, электролиз — очень энергозатратный процесс, а энергия в космосе и без того «на вес золота».
Альтернативой является использование фотокатализаторов, которые работают путем поглощения фотонов полупроводниковым материалом, размещенном в воде. Энергия фотона «выбивает» электрон из материала, оставляя в нем «дырку». Свободный электрон может взаимодействовать с протонами в воде с образованием атомов водорода. Между тем, «дырка» может поглощать электроны из воды с образованием протонов и атомов кислорода.
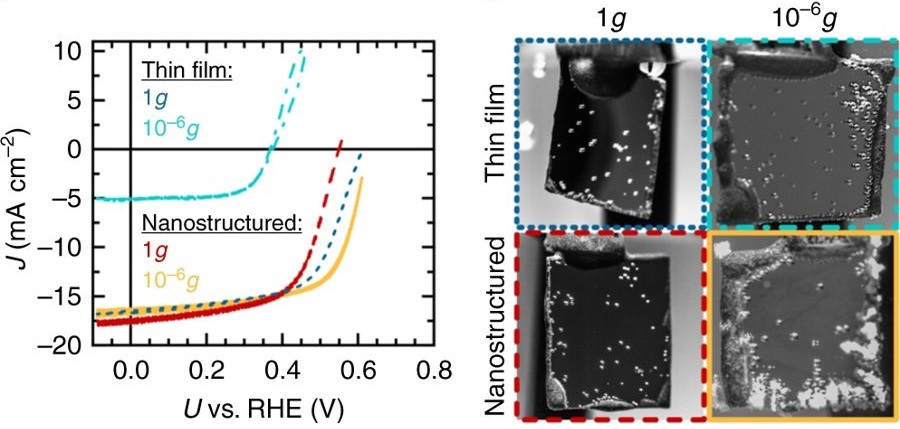
Процесс фотокатализа в земных условиях и при микрогравитации (в миллион раз меньше, чем на Земле). Как видно, во втором случае количество появляющихся пузырьков газа больше.
Этот процесс может быть повернут вспять. Водород и кислород могут быть рекомбинированы (объединены) с использованием топливного элемента, в результате чего «вернется» затраченная на фотокатализ солнечная энергия и образуется вода. Таким образом, эта технология — реальный ключ к дальним космическим путешествиям.
Процесс с использованием фотокатализаторов является наилучшим вариантом для космических путешествий, поскольку оборудование весит намного меньше, чем необходимое для электролиза. В теории, работать с ним в космосе также проще. Отчасти это объясняется тем, что интенсивность солнечного света вне атмосферы Земли существенно выше, так как в последней достаточно большая часть света поглощается или отражается по пути к поверхности.
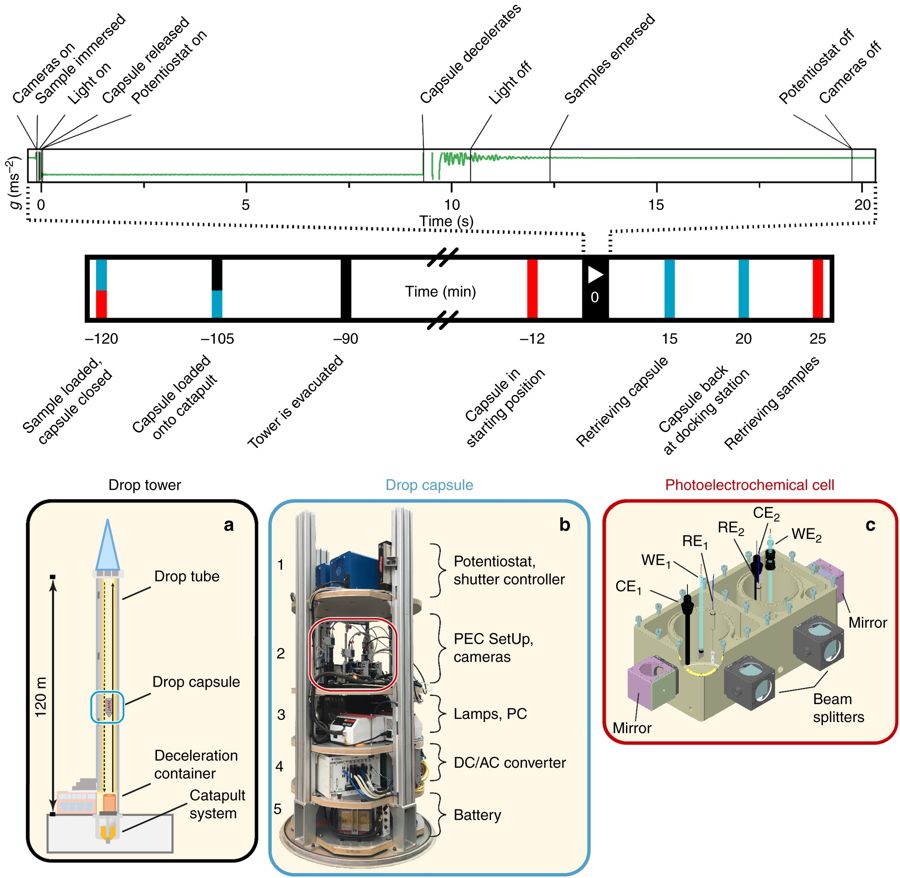
В новом исследовании ученые сбросили полностью рабочую экспериментальную установку для фотокатализа с башни высотой в 120 метров, создав условия, называющиеся микрогравитацией. По мере того, как объекты падают на Землю в свободном падении, эффект гравитации уменьшается (но сама она никуда не исчезает, поэтому это и называют микрогравитацей, а не отсутствием гравитации — прим. перев.), поскольку нет сил, которые компенсируют притяжение Земли — таким образом, на время падения в установке создаются условия как на МКС.
Экспериментальная установка и процесс эксперимента.
Исследователям удалось показать, что в таких условиях действительно возможно раcщепить воду. Однако, поскольку при этом процессе получается газ, то в воде образуются пузырьки. Важной задачей является избавление от пузырьков материала катализатора, поскольку они препятствуют процессу создания газа. На Земле гравитация заставляет пузырьки всплывать на поверхность (вода около поверхности плотнее пузырьков, что позволяет им плавать на поверхности), освобождая пространство у катализатора для образования следующих пузырьков.
При невесомости это невозможно, и пузырьки газа остаются на катализаторе или около него. Тем не менее, ученые скорректировали форму катализатора в наноразмерных масштабах, создав пирамидальные зоны, где пузырек может легко оторваться от вершины пирамиды и попасть в воду, не препятствуя процессу образования новых пузырей.
Но остается одна проблема. В отсутствие силы тяжести пузырьки останутся в жидкости, даже несмотря на то, что они вынуждены были покинуть катализатор. Гравитация позволяет газу легко выходить из жидкости, что имеет решающее значение для использования чистого водорода и кислорода. Без гравитации никакие пузырьки газа не плавают на поверхности и не отделяются от жидкости — вместо этого образуется аналог пены.
Это резко снижает эффективность процесса, блокируя катализаторы или электроды. Инженерные решения вокруг этой проблемы будут ключевыми для успешной реализации технологии в космосе — одно из возможных решений заключается в вращении установки: таким образом центробежные силы создадут искусственную гравитацию. Но, тем не менее, благодаря этому новому исследованию мы стали на шаг ближе к длительному космическому полету людей.
Астрофизики знают, что для звездообразования необходимо топливо. Современная теория гласит, что реки водорода — известные как «холодные потоки» — могут быть своего рода переправами водорода через межгалактическое пространство и, следовательно, подпитывать процесс звездообразования.
Спиральные галактики, как наш Млечный Путь, как правило, имеют довольно спокойный, но устойчивый темп звездообразования. Другие галактики, такие как NGC 6946, которая находится примерно в 22 млн. световых лет от Земли на границе созвездий Цефея и Лебедя, гораздо более активны в этом плане. Это поднимает вопрос о том, что является питательной средой для устойчивого формирования звезд в этой и аналогичных ей спиральных галактиках.
Предыдущие исследования ближайшего галактического пространства вокруг NGC 6946 с телескопа WSRT в Нидерландах выявили протянутое гало водорода. Однако, холодный поток мог быть сформирован водородом совсем из другого источника — газом из межгалактического пространства, который никогда не нагревался до высоких температур процессом рождения звезд.
Используя Green Bank Telescope (GBT), Пизано удалось обнаружить свечение, испускаемое нейтральным водородом, соединяющим NGC 6946 с его космическими соседями. Этот сигнал был просто ниже порога обнаружения других телескопов, но уникальные возможности GBT позволили ученому обнаружить это слабое излучение.
Астрономы уже давно предположили, что крупные галактики могут получать постоянный приток холодного водорода с помощью его откачки с других менее массивных компаньонов.
Дальнейшие исследования помогут подтвердить природу этого наблюдения и помогут пролить свет на возможную роль, которую холодные потоки играют в эволюции галактик.
Обобщающая схема «ВОДОРОД»
I.Водород – химический элемент
а) Положение в ПСХЭ
- порядковый номер №1
- период 1
- группаI(главная подгруппа «А»)
- относительная массаAr(Н)=1
- латинское название Hydrogenium (рождающийводу)
б) Распространённость водорода вприроде
| Водород — химический элемент. | В земной коре (литосфера и гидросфера) – 1% по массе(10 местосреди всех элементов) |
| АТМОСФЕРА — 0,0001% по числу атомов | |
| Самый распространённый элемент во вселенной – 92% от числа всех атомов(основная составная часть звёзд и межзвёздного газа) |
| Водород – химический элемент | В соединениях | Н 2 О – вода (11% по массе) |
| СН 4 – газ метан (25% по массе) | ||
| Органические вещества (нефть, горючие природные газы идругих) В организмах животных и растений (то есть в составе белков,нуклеиновых кислот, жиров, углеводов и других) В теле человека в среднем содержится около 7 килограммов водорода. в) Валентность водорода в соединениях II. Водород – простое вещество (Н 2) Получение
|